
Amprente ale unei patologii pulmonare cronice - IMAGINI DIN PRACTICA CLINICĂ
Amprente ale unei patologii pulmonare cronice
Victor Botnaru1, Irina Voloșciuc1*, Diana Calaraș1, Oxana Munteanu1
1Disciplina de pneumologie și alergologie, Departamentul de medicină internă, Universitatea de Stat de Medicină și Farmacie „Nicolae Testemiţanu”, Chișinău, Republica Moldova.
Autor corespondent:
Irina Voloșciuc, asistent universitar
Disciplina de pneumologie și alergologie, Departamentul de medicină internă
Universitatea de Stat de Medicină și Farmacie „Nicolae Testemiţanu”
bd. Ștefan cel Mare și Sfânt, 165, Chișinău, Republica Moldova, MD-2004
e-mail: irina.volosciuc@usmf.md
Titlu scurt: Amprente ale unei patologii pulmonare cronice
Întrebări:
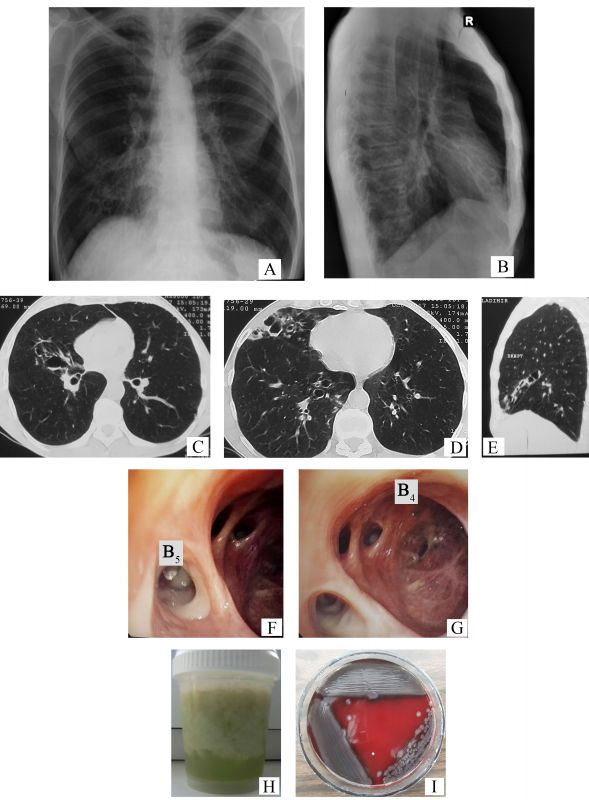
- Descrieți modificările identificate în radiografia cutiei toracice (Figurile 1 A și 1 B).
- Numiţi leziunile imagistice vizualizate suplimentar prin computer tomografie (Figurile 1 C-E).
- Descrieți tabloul endoscopic al bronhiilor (Figurile 1 F-G) ce caracterizează leziunile imagistice identificate la computer tomografie.
- Care ar fi agentul patogen izolat din sputocultură (un alt pacient), pornind de la aspectul macroscopic al sputei (Figura 1 H) și morfologia coloniilor bacteriene (Figura 1 I), mediul de cultură fiind geloză-sânge?
Răspunsuri:
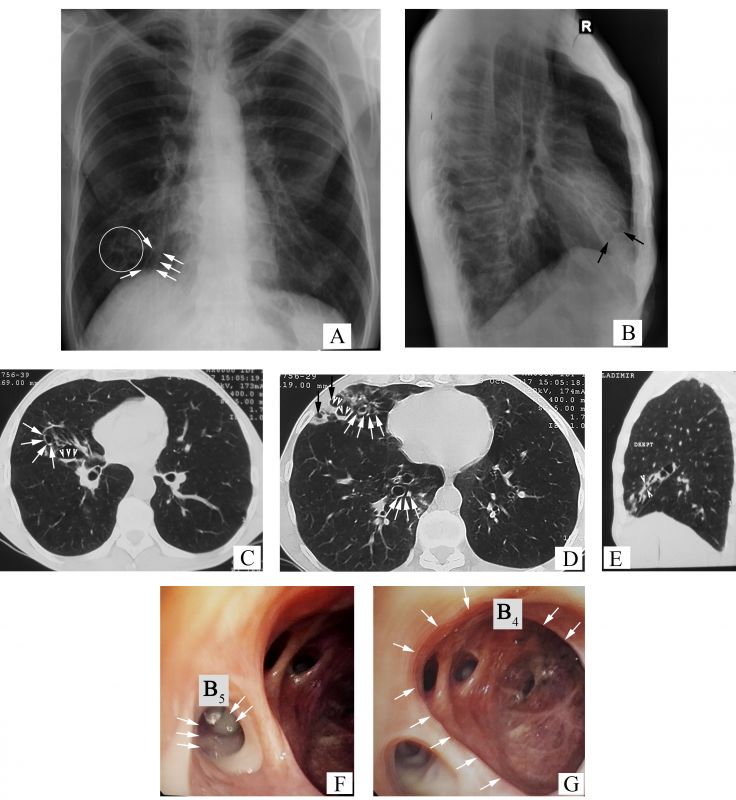
- Radiografia toracelui atestă semnul „șinelor de tramvai” – linii paralele grosiere, care reprezintă pereții bronșici îngroșați (săgeți, Figura 2 A), multiple opacități inelare dispuse în rozete Ameuille (cerc, Figura 2 A) – considerate semn caracteristic pentru bronșiectazii, unele dintre ele fiind cu nivel hidroaeric (săgeți, Figura 2 B), cu localizare în lobul mediu pe dreapta (LMD). Se mai observă și modificări retractile (deplasarea apicală a domului hemidiafragmal drept, umbra cardiacă pe linia mediană) la nivelul LMD (apropierea scizurii orizontale de scizura mare), de rând cu manifestările sindromului de hiperinflație (cutia toracică „în butoi”, rotunjirea domulurilor pleurale, orizontalizarea coastelor cu lărgirea spațiilor intercostale, „cord în picătură”, mărirea diametrului anteroposterior cu lărgirea spațiului transparent retrosternal).
- În imaginile de la computer tomografie (CT) se vizualizează semne certe de bronșiectazii, precum: semnul „inelului cu pecete” – diametrul intern al bronhiei mult mai mare față de diametrul arterei adiacente (săgeți albe, Figurile 2 C-D), bronșiectazii varicoase și bronșiectazii chistice, unele dintre ele cu secreții endobronșice – nivele hidroaerice (vârfuri de săgeți în Figura 2 C și Figura 2 D), semnul „degetului de manușă” (vârfuri de săgeți, Figura 2 E) și vizualizarea bronhiilor dilatate la periferia pulmonului (săgeți negre, Figura 2 D).
- Mucoasa bronhiilor segmentare din LMD este hiperemiată difuz. În lumenul bronhiei segmentare mediale (B5) prezente secreții bronșice purulente (săgeți, Figura 2 F). La nivelul bronhiei segmentare laterale (B4), orificiul și lumenul apar dilatate (săgeți, Figura 2 G), mucoasa bronșică este atrofică cu cicatrizare, iar orificiile bronhiilor subsegmentare deformate și îngustate.
- Bacilul piocianic (Pseudomonas aeruginosa). Nuanța verzuie a sputei redă un grad înalt al purulenței (în special, sputa stagnantă), fiind determinată de un nivel crescut de mieloperoxidază (verdoperoxidază) eliberată din neutrofile. Această nuanță verzuie a secrețiilor bronșice se atestă în infecții cu diferite microorganisme potențial patogene (MPP), precum Pseudomonas aeruginosa, Haemophilus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis, Staphylococcus aureus, Klebsiella pneumoniae, dar colorația intensă în verde cu nuanță verde-albastru este caracteristică bacilului piocianic („bacilul puroiului albastru") datorită producerii unor pigmenți, fiind suplimentar observată și în infecțiile prin bacilul piocianic ale marilor arși, în traumatismul sever, în sepsis, în leziuni oculare (cheratite, endoftalmite), în otite medii, în infecții respiratorii la pacienții cu imunosupresie profundă. Pe mediul de cultură geloză-sânge, coloniile de Pseudomonas aeruginosa sunt hemolitice și au un luciu metalic [1].
CAZ CLINIC
Bărbat în vârstă de 52 de ani, fumător activ (indicele fumătorului = 35 de pachete-an) se adresează la pneumolog (septembrie, 2017) pentru tuse cu expectorații purulente (50 ml/24 de ore), dispnee la efort fizic moderat, wheezing periodic. Fără anamnestic de tuberculoză tratată, dar cu istoric de pneumonie pe dreapta (1985), din acel moment persistând tusea cronică cu sau fără expectorații în cantități variabile, medicul de familie încadrând fenomenul în bronșita cronică. Ultimii 5 ani cu agravare de 2-3 ori pe an a simptomelor respiratorii (sporirea bronhoreei, creșterea gradului de dispnee). La examenul obiectiv, pacientul subponderal (IMC 18 kg/m2), fără edeme gambiene, cu diminuarea bilaterală a murmurului vezicular și normoxemic (SaO2 96% la respirație cu aer ambiant). Valorile spirometrice în limitele normalului (VEMS 99%, CVF 93%, VEMS/CVF 86%). Radiologic au fost suspectate bronșiectazii în lobul mediu pe dreapta, confirmate prin CT toracelui. În sputocultură a fost identificat Pseudomonas aeruginosa.
DISCUȚII
Bronșiectaziile reprezintă o afecțiune respiratorie progresivă a căilor aeriene, definită anatomic prin dilatație anormală și ireversibilă a bronhiilor, manifestată clinic prin tuse, expectorații și infecții respiratorii recurente [2]. La adulți, simptomul de bază este tusea cronică cu spută mucopurulentă (până la 80% din cazuri). Pe măsură ce crește severitatea bolii, pot apărea și alte manifestări (de exemplu, dispnee, hemoptizie, pierderea ponderală, astenie) [3]. Bronșiectaziile se pot observa la persoane de orice vârstă, însă, prevalența crește odata cu vârsta. Conform unor studii din Germania (2015), prevalența bronșiectaziilor în populația generală este de 67 cazuri la 100.000 populație, cu o creștere vertiginoasă în rândul persoanelor cu vârsta >75 de ani (depășind 200 de cazuri la 100.000 populație) [4]. Etiologia bronșiectaziilor este foarte variată, ele constituind calea finală comună a mai multor afecțiuni infecțioase (pneumonie, tuberculoză), alergice (astmul bronșic), genetice (fibroza chistică) și degenerative [5].
Dilatarea bronhiilor poate fi suspectată la o radiografie, în trecut acestea fiind confirmate prin bronhografie. La moment, însă, bronhografia este înlocuită de CT, o metodă sigură, ușor tolerată și care oferă informații mult mai ample [2].
Semnele caracteristice bronșiectaziilor la CT sunt: un raport bronho-arterial (RBA) >1, opacități liniare paralele (semnul „șinelor de tramvai”), dispariția dihotomizării bronșice normale, vizualizarea bronhiilor la periferia plămânilor [6].
Un raport dintre diametrul intern al bronhiei și diametrul arterei pulmonare adiacente peste 1 se consideră patologic și definește semnul „inelului cu pecete”. Acuratețea acestui semn este limitată, fiind influențată și de alți factori, cum ar fi altitudinea ridicată (din cauza vasoconstricției și bronhodilatației hipoxice are loc creșterea RBA și micșorarea grosimii pereților bronșici), secțiunea CT examinată (planul de examinare corect este unul orientat perpendicular pe traiectul bronhiilor), vârsta pacientului (RBA crește odată cu vârsta) [6-9]. De asemenea, există dovezi că la pacienții cu bronhopneumopatie obstructivă cronică, RBA este mărit din contul reducerii diametrului arterei, dar nu din creșterea diametrului bronhiei [10]. Având în vedere posibilitatea de diagnostic fals-pozitiv al bronșiectaziilor conform RBA, se recomandă ca diagnosticul să nu fie bazat doar pe datele imagistice, dar să se ia în considerație și neutrofilia în căile respiratorii [5]. Dispariția dihotomizării bronșice normale este un alt criteriu de bronșiectazii la CT (necesar ca diametrul bronhiei să rămână neschimbat pe parcursul a cel puțin 2 cm, distal de ultimul punct de ramificație bronșică – Figura 4 A). În mod normal, bronhiile nu pot fi vizualizate la o distanță mai mică de 1 cm de pleura costală. Odată ce devin vizibile, constatăm prezența unor dilatări anormale ale bronhiilor (săgeată neagră, Figura 4 B) [6].
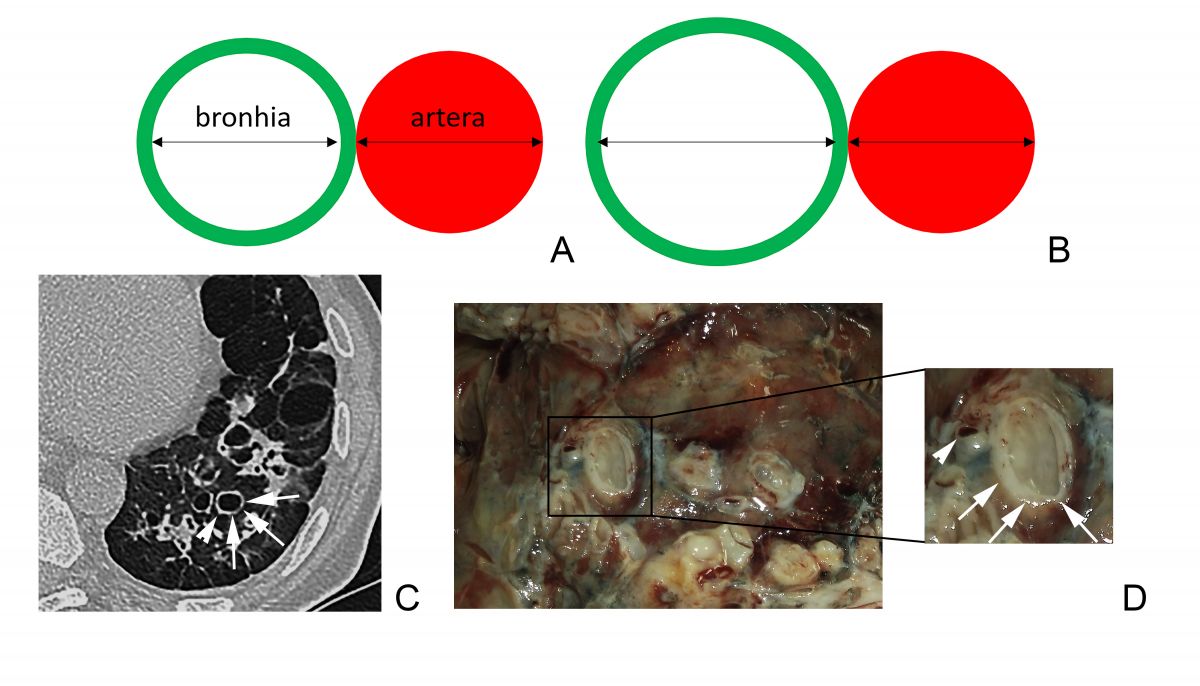
Fig. 3 Broncho-arterial ratio. A. BAR = 1, normal value. B. BAR >1 characteristic for bronchiectasis. C. Thoracic CT plane with the ”signet-ring” sign – dilated bronchi (arrows) next to an artery with a normal diameter (arrowhead). D. (Contribution of Dr. Haidarlâ I.) Morphologic aspect, dilated bronchi (arrows) next to an artery with normal diameter (arrowhead).
Semnele imagistice secundare de bronșiectazii la CT sunt îngroșarea pereților bronșici (săgeți albe, Figura 4 B), impactarea cu mucus a bronhiilor mari dilatate – semnul „degetului de mănușă” (săgeți, Figura 4 C) și a bronhiilor mici – semnul „arborelui înmugurit” (vârfuri de săgeți albe, Figura 4 B), capturarea aerului (vârf de săgeată neagră, Figura 4 B) [6].
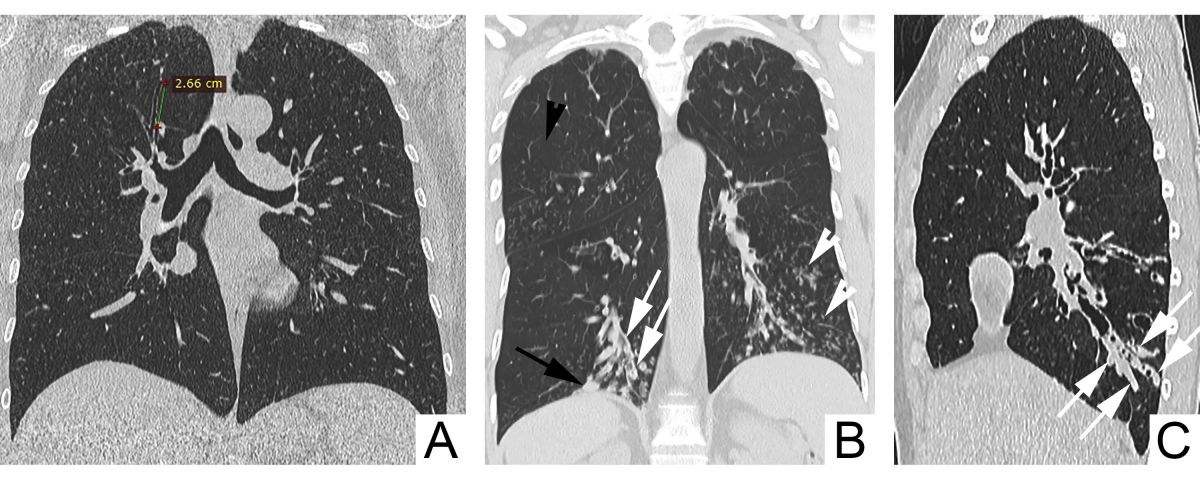
Fig. 4 Signs of bronchiectasis on CT. A. Nontapering bronchi with a constant diameter over >2 cm. B. Visible bronchi within 1 cm of the costal pleura (black arrow), bronchial wall thickening (white arrows), mucoid impaction of small caliber bronchi – the ”tree-in-bud” sign (white arrowheads), air-trapping (black arrowhead). C. Mucoid impaction of dilated large caliber bronchi – the ”finger-in-glove” sign (arrows).
Diferitele tipurile morfologice de bronșiectazii ce corespund clasificării bronhografice a lui Reid, prezintă diferite semne imagistice, astfel încât, în bronșiectaziile cilindrice se identifică dilatări uniforme ale bronhiilor fără dihotomizare (vârfuri de săgeți albe, Figura 5), în cele varicoase – dilatări cu aspectul „în șirag de mărgele” (săgeți albe, Figura 5), iar în bronșiectaziile chistice se vizualizează dilatări bronșice grosiere asemănătoare unor chisturi (săgeți negre, Figura 5) [11].
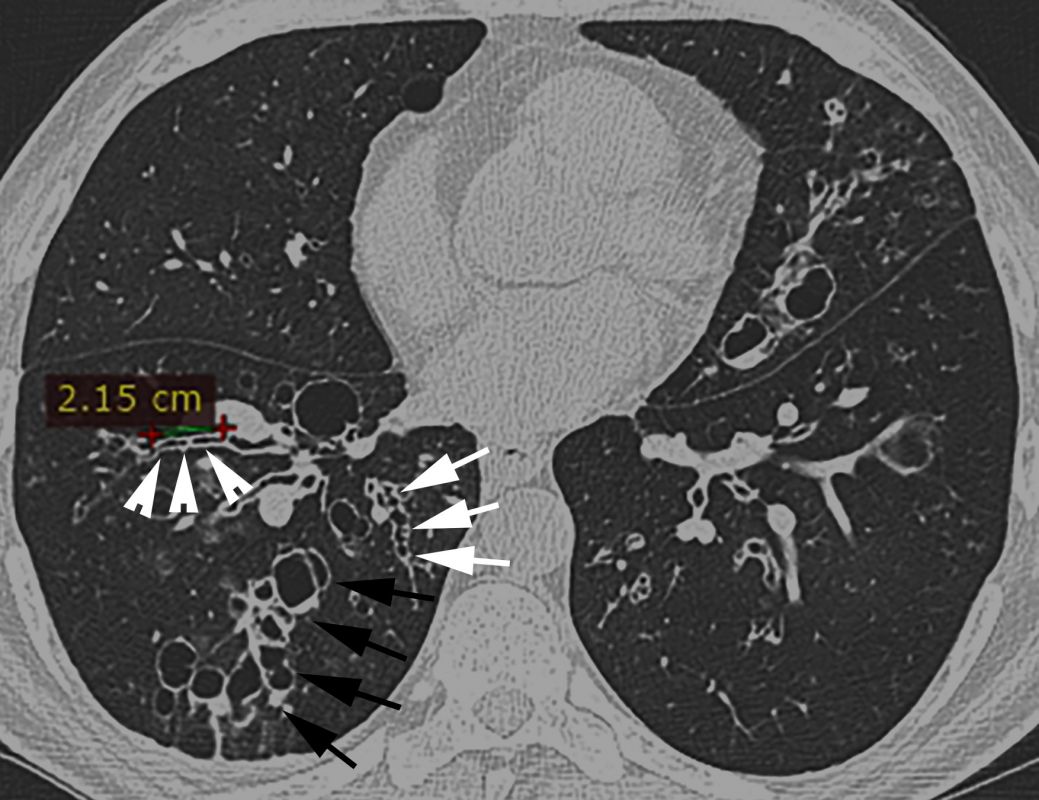
Fig. 5 Morphological types of bronchiectasis: cylindrical (white arrowheads), varicose (white arrows), cystic (black arrows).
Evoluția clinică și imagistică a bronșiectaziilor depinde de agentul patogen izolat din spută sau din lavajul bronhoalveolar. În 80% cazuri prin sputocultură se atestă cel puțin unul dintre MPP (Pseudomonas aeruginosa, Haemophilus influenzae, Moraxella catarrhalis, Streptococcus pneumoniae, Staphylococcus aureus), mai frecvent fiind Pseudomonas aeruginosa [5, 6].
Pseudomonas aeruginosa, sau bacilul piocianic (bacilul puroiului albastru, datorită capacității sale de a colora în verde-albastru puroiul), este gram negativ, mobil, oxidazo-pozitiv, nesporulat. Este ubicuitar, fiind întâlnit în sol, apă, plante, materii organice în descompunere, dar și în mediul spitalicesc (sisteme de canalizare, vaze cu flori, echipamentul de respirație artificială, unele dezinfectante), unde determină infecţii nosocomiale greu de tratat din cauza multirezistenţei la antibiotice. La om, poate face parte din flora intestinală sau tegumentară normală. Cu toate că dispune de o mare varietate de factori de virulenţă (prezenţa pililor, producerea unor proteaze cu efecte histotoxice, sinteza de hemolizine, exotoxine şi existenţa endotoxinei), Pseudomonas aeruginosa este un agent condiționat patogen [12]. Pentru a induce boala este necesară o deteriorare a mecanismelor de protecție a gazdei, prin lezarea integrității barierelor mecanice (piele, membrană mucoasă) sau prezența deficitelor imune (neutropenie, imunosupresie) [13].
Identificarea bacilului piocianic este simplă datorită caracterelor sale culturale. Pe geloză simplă sau bulion, înverzeşte mediul datorită secreţiei piocianinei (pigment fenazinic albastru, nefluorescent, solubil în apă), care se combină cu pioverdina (pigment galben-verzui, fluorescent) [12]. Pe mediul de cultură geloză-sânge coloniile apar lucioase, cu aspect metalic, hemolitice (Figura 1 I) și degajă un miros caracteristic de „flori de salcâm” [14].
La pacienții cu bronșiectazii, izolarea bacilul piocianic este asociată cu prezența bronșiectaziilor severe (caracterizate, predominant, de un pattern morfologic chistic și o distribuție multisegmentară), cu o progresare mai rapidă a leziunilor pulmonare, cu o creștere a ratei mortalității / spitalizărilor și cu o calitate a vieții mult mai redusă [15-17].
CONCLUZII
Bronșiectaziile se vor suspecta la un pacient cu simptome respiratorii cronice și bronhoree importantă, computer tomografia fiind metoda de elecție în confirmarea acestora, în cazul prezenței semnelor imagistice caracteristice bronșiectaziilor la radiografia toracelui (opacități inelare, semnul „șinelor de tramvai”). Aspectul macroscopic al sputei poate sugera prezența unui MPP, cum ar fi Pseudomonas aeruginosa, identificarea căruia este un marker al prognosticului nefavorabil și impune o abordare mai specială.
Declarația de conflict de interese
Nimic de declarat.
REFERINȚE / REFERENCES
- Miravitlles M. et al. Sputum colour and bacteria in chronic bronchitis exacerbations: a pooled analysis. European Respiratory Journal, 2012; 39 (6): 1354-1360.
- Botnaru V., Munteanu O., Balica I., Calaraș D. Bronșiectaziile la adult. Protocol Clinic Național. Republica Moldova, 2017. 275: p. 27-31.
- Dimakou K., Triantafillidou C., Toumbis M., Tsikritsaki K., Malagari K., Bakakos P. Non CF-bronchiectasis: aetiologic approach, clinical, radiological, microbiological and functional profile in 277 patients. Respiratory Medicine, 2016; 116: 1-7.
- Ringshausen F. et al. Bronchiectasis in Germany: a population-based estimation of disease prevalence. Eur. Respir. J., 2015; 46 (6): 1805-7.
- Chalmers J., Chang A., Chotirmall S., Dhar R., McShane P.. Bronchiectasis. Nature Reviews Disease Primers, 2018; 4 (1): 45.
- Floto R., Haworth C. Bronchiectasis. European Respiratory Society Monograph, 2011; 52: 32-43.
- Matsuoka S. et al. Bronchoarterial ratio and bronchial wall thickness on high-resolution CT in asymptomatic subjects: correlation with age and smoking. AJR Am. J. Roentgenol., 2003; 180 (2): 513-8.
- Matsuoka S., Uchiyama K. et al. Bronchoarterial ratio and bronchial wall thickness on high-resolution CT in asymptomatic subjects: correlation with age and smoking. American Journal of Roentgenology, 2003; 180 (2): 513-518.
- Joung K., Müller N. et al. Bronchoarterial ratio on thin section CT: comparison between high altitude and sea level. Journal of Computer Assisted Tomography,1997; 21 (2): 306-311.
- Diaz A. et al. Bronchoarterial ratio in never-smokers adults: implications for bronchial dilation definition. Respirology, 2017; 22 (1): 108-113.
- Reid L. Reduction in bronchial subdivisions in bronchiectasis. Thorax, 1950; 5: 233-247.
- Licker M. ş.a. Curs de microbiologie specială, îndreptar de lucrări practice. Ed. „Victor Babeş”, Timişoara, 2019.
- Bassetti M., Vena A., Croxatto A., Righi E., Guery B. How to manage Pseudomonas aeruginosa infections. Drugs in Context, 2018; 7: 212-527.
- Lederberg J. et al. Pseudomonas. Encyclopedia of Microbiology. Second Edition. Volume 3. San Diego, 2000. p. 876-891.
- Finch S., McDonnell M., Abo-Leyah H. et al. A comprehensive analysis of the impact of Pseudomonas aeruginosa colonization on prognosis in adult bronchiectasis. Ann. Am. Thorac. Soc., 2015; 12: 1602-1611.
- Lynch et al. Correlation of CT findings with clinical evaluations in 261 patients with symptomatic bronchiectasis. American Journal of Roentgenology, 1999; 173 (1): 53-58.
- Park J. et al. Factors associated with radiologic progression of non-cystic fibrosis bronchiectasis during long-term follow-up. Respirology, 2016; 21 (6): 1049-54.
